点击微信咨询
1364994806  (扫码)
(扫码)
私人堕胎药包邮货到付款,货到付款|全国包邮|正品便宜打胎药|
黄金会员 提醒:女人总要受各种累,学会保护自己才是最重要的,世界上没有后悔药,但有流产药,意外或是没有准备好的姐妹可以通过药流来“后悔”紧急措施,但温馨提醒,这只是紧急,不能常用,不然会伤害自己的身体。女人要爱自己多点,多做保护措施!
私人堕胎药包邮货到付款 ,添加文内微信免费咨询!
郑重承诺:堕胎药、堕胎药米非司酮片全国范围顺丰速递保密派送,全程指导用药!(详情请咨询)
专业药师在线指导,合理用药,更健康,私人堕胎药包邮货到付款 ,在线咨询,承诺正品全国包邮。
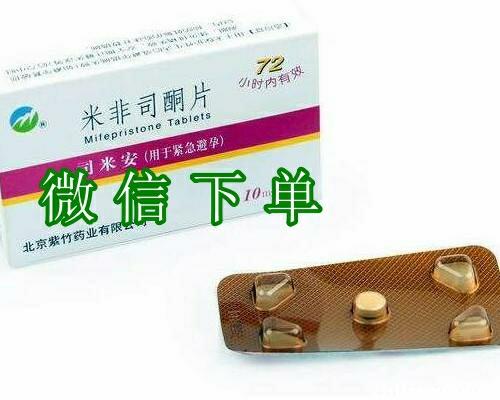
私人堕胎药包邮货到付款 -药品介绍
商品名称 米非司酮
通用名称 米非司酮
英文名 Mifepristone
批准文号 国药准字H
规格 ----
用法用量 口服给药:
HY112。zhiLi123。com1.终止早孕:停经49天内的健康早孕妇女,服用米非司酮方案有两种:
(1)顿服200mg;
(2)每次25mg,每天2次,连续3天。第3或第4天清晨于阴道后穹隆放置卡前列甲酯栓1mg(1枚),或使用其他同类前列腺素药物,卧床休息1h后再起床,以免药物流出。如使用米索前列醇口服片,则服用400~600μg(2~3片),在门诊观察6h,注意用药后出血情况,有无胎囊排出和不良反应,并且必须按药物流产常规的要求进行观察和随访。
2.用于中、晚期胎死宫内:每次200mg,每天2次,或每次600mg,每天1次,连服2天。
分类 化学药品
剂型 原料药
外用药 否
国家/地区 国产
HY112。zhiLi123。com生产企业 浙江仙居君业药业有限公司
私人堕胎药包邮货到付款 -不良反应
1.主要为腹泻,恶心或呕吐,腹痛等,采用复方地芬诺酯(复方苯乙哌啶)片后,不良反应显著减少。停药后上述反应即可消失。
2.少数人面部潮红,很快消失,注意观察前列腺素可能引起的一般副作用,如肠胃道、心血管系症状等。
私人堕胎药包邮货到付款 -药理
米非司酮为受体水平抗孕激素药,具有终止早孕、抗着床、诱导月经及促进宫颈成熟等作用,与孕酮竞争受体而达到拮抗孕酮的作用,与糖皮质激素受体亦有一定结合力。米非司酮能明显增高妊娠子宫对前列腺素的敏感性。小剂量米非司酮序贯合并前列腺素类药物,可得到满意的终止早孕效果。

私人堕胎药包邮货到付款,货到付款|全国包邮|正品便宜打胎药|
女性在怀孕初期最明显的症状就是月经没有按时来,随后就会感觉到有头晕、嗜睡、恶心、呕吐、牙疼等等,每个人的在怀孕之后的症状都是不一样的,需要尽快到医院确诊比较好。
1.停经:女性到了成熟的年龄时,都会每个月在固定的时间里来月经,一旦在没有进行避免措施或者是备孕后,月经如果没有按时来潮,并且推迟到七天或者是十天以上,就应该考虑是怀孕引起的,当然还有其他原因也会导致停经,单凭不来月经判断是否怀孕并不能百分之百准确。
2.早孕反应:女性在怀孕之后,身体就会出现不同程度的反应,有的人反应大一些,有的人反应小一些,都是个人身质的原因,一般都是会出现身体乏力、嗜睡、厌食、恶主、呕吐等症状,这些症状等到了孕中期时就会自行消失,大家也不需要过渡的担心。
3.尿频:在孕初期时尿频应该是比较普遍的现象,很多孕妇也许并不认为是孕期反应,其实这是因为子宫增大后压迫膀胱导致的,而不是因为过量饮水的原因,等到了12周之后尿频的情况也会消失。
复方米非司酮片痛吗
问题描述:复方米非司酮片痛吗
HY112。zhiLi123。com问题分析:
米非司酮片用于无保护性生活后或避孕措施失败(如避孕套破损、滑脱,体外排精失败,安全期计算失误等)后72小时以内,预防妊娠临床补救措施。米非司酮片与前列腺素药物序贯合并使用,可用于终止停经49天内的妊娠。如果是用于终止妊娠是有可能会出现疼痛和出血的,这是一个处方药物,患者必须在医生的指导下正确用药。
意见建议:
患者应该听从主治医生的意见,按时按量进行用药治疗,这样才尽可能地达到药到病除的效果,要注意加强营养,应该多补充一些含优质蛋白的食物,可以起到增强体质的作用,但是也要注意不要过于的油腻,影响正常的消化和吸收。

私人堕胎药包邮货到付款,货到付款|全国包邮|正品便宜打胎药|
药流能控制不完全流产的发生吗
我今年22岁,在老家订婚以后跟我对象一起来广州打工,去年来了这个厂待遇不错,干着也还满意,我们在工厂附近的村子里租了一个小单间,每月也花不了多少钱,平时在性生活方面也比较注意,一般在安全期内没有使用避孕措施,那么长时间了也没事,可是这个月月经一直没来,开始没在意,一直过了十几天都没来就去买了试纸,检查以后才知道是怀孕了,想做药流,药流能控制不完全流产的发生吗?
1、 意外怀孕在现在社会是很普遍的想象,一般有过性经历的女性都有可能经历,药物流产应该算是比较普遍的一种方法,但是药流能不能避免不完全的流产并不一定就能很肯定的保障,这是任何人都不能决定的。
2、 药物流产不完全引起宫腔残留了必须要做清宫手术,不然会对卵巢造成伤害甚至是影响以后的生育能力,引起流产不完全的原因也有很多,比如说宫颈炎症,胎儿体积过大,子宫口比较小不利于残留物排除等等。
3、 如果决定使用药物流产了一定要在正规的医院或者是有职业医生资格证的诊所检查以后在医生的指导下用药,吃最后一次药的时候最好要有医生在场,以免发生大出血等意外对身体造成伤害。
注意事项:
流产后一定要卧床休息,不能吃凉的东西不能使用凉水,不要干体力活,在下次月经结束前禁止同房,下次月经结束后最好是去医院做个复查。
-----------------以下为新闻资讯,可略过!-----------------------
字少事大
2023年以来,不少国家/地区的医疗器械政策与法规均陆续有所变化。本期特别梳理精选:前三季度全球范围国家/地区的政策面情况(以下排名不分先后)。
中国
1.7月,国家药监局印发《关于进一步加强和完善医疗器械分类管理的意见》。
HY112。zhiLi123。com2.GB 9706在我国得到进一步的推动实施:
·GB 9706.1-2020医疗电气设备 第1部分:基本安全和基本性能的通用要求,等同于IEC 60601-1-2012,作为强制性国家标准,已于2023年5月1日起正式实施。
·自2023年5月1日起,医疗器械检验中心对新版GB 9706系列标准的注册检验申请应优先受理。
·CNCA及相关机构根据申请优先开展新GB 9706系列标准检测能力相关资质认定工作及技术审查。
3. 启动制定《医疗器械管理法》:9月8日,第十四届全国人大常委会印发关于医疗器械管理法的立法计划。
4.关于征集参与《猴痘病毒核酸检测试剂注册审查指导原则》编制工作的相关企业及单位信息的通知:为进一步做好猴痘病毒核酸检测相关产品的技术审评工作,已启动《猴痘病毒核酸检测试剂注册审查指导原则》的编制工作。现征集编制工作参与单位,邀请具有相关工作经验的境内外生产企业、科研机构、临床机构等积极参与。
欧盟
1.3月20日,Regulation(EU)2023/607发布,MDR/IVDR法规过渡期再度被调整。
2.公告机构总数增加至50家(39家MDR机构+11家IVDR机构),HTCert成为第39家欧盟MDR审核公告机构;Eurofins Electric&Electronics Finland Oy成为第11家欧盟IVDR审核公告机构。
3.2023年第2季度,完成IVDR的欧盟参考实验室选择。
4.EUDAMED数据库的剩余模块依旧需进行用户功能测试。
5.2023年第4季度预计将指定5家参考实验室EURL。
美国
1.CDRH国际协调战略计划
策略1:加强参与国际协调、趋同和信赖;
策略2:创建与可信赖合作伙伴分享最佳实践的机制;
策略3:评估CDRH实施IMDRF技术文件的程度;
策略4:支持创建论坛,与利益相关者互动,与监管部门相互借鉴决策方法;
策略5:参与外展活动,以鼓励协调、趋同和信赖。
2.510(k)更新计划
·《选择等同器械以支持上市前通知510(k)提交的最佳实践》
·《上市前通知510(k)提交临床数据使用建议》
·《植入器械510(k)的证据预期》
·《510(k)提交的电子提交模板最终指南文件》
·《突破性器械指南更新》
3.更新SaMD相关文件,加强国际一致性并确保持续的一致性、可预测性和透明度。
英国
1.为加强英国市场对CE标识器械的接受度,修订The Medical Device Regulations 2002 (SI 2002 No 618,as amended),扩充CE 标志医疗器械在英国市场上的认可范围,为英国医疗器械的持续安全供应提供支持,并缓解向未来监管框架的过渡。
2.截至2023年8月,MHRA指定3家新的英国公告机构UK Approved Bodies,由此可将英国医疗器械认证能力提高近1倍,有助于为医疗保健专业人员和公众加快认证安全有效的医疗器械。新增机构为:TÜV南德、天祥集团、TÜV莱茵英国。
3.根据政府对公众咨询的回应,将实施有关CE标识和UCKA产品上市后监督的新规定。
4.为支持创新医疗器械开发而推出新的上市前途径IDAP即Innovative Devices Access Pathway。
3.2024年起,MHRA将采用一种新的国际互认模式,即:允许对已获得美国、欧洲或日本等其他国家地区可信赖的监管机构批准的药品和技术,进行快速、高度自动化的签批。
澳大利亚
TGA认可ISO13485证书作为IVD制造商证据的过渡期,已于2023年5月26日结束,意味着:TGA不再认可ISO13485证书用于IVD认证申请。
已获批澳大利亚认证申请并持有ISO13485证书的IVD,其证书在到期之前仍保持有效。
制造商将需要另一种形式可接受的证据以支持器械申请,TGA将考虑以下文件:
·特定海外监管机构和评估机构所发布的与TGA符合性评估摘要请求有关的具体证据和文件;
·纳入ARTG(TGA注册管理系统)申请所需的文件。
具体包括有:
·欧盟成员国医疗器械监管机构指定的公告机构,根据欧盟医疗器械监管框架颁发的证书;
·美国食品药品监督管理局FDA的决定;
HY112。zhiLi123。com·加拿大卫生部颁发的批准和许可证;
·日本上市前批准(由厚生劳动省、药品和医疗器械管理局或注册认证机构发布);
·新加坡健康科学管理局(HSA)注册;
·根据医疗器械单一审核计划MDSAP颁发的证书和报告。
瑞士
瑞士医疗器械数据库swissdamed,将从2024年初开始向公众开放经济运营商数据,自愿器械注册预计将从2024年夏季开始提供。

