点击微信咨询
1364994806  (扫码)
(扫码)
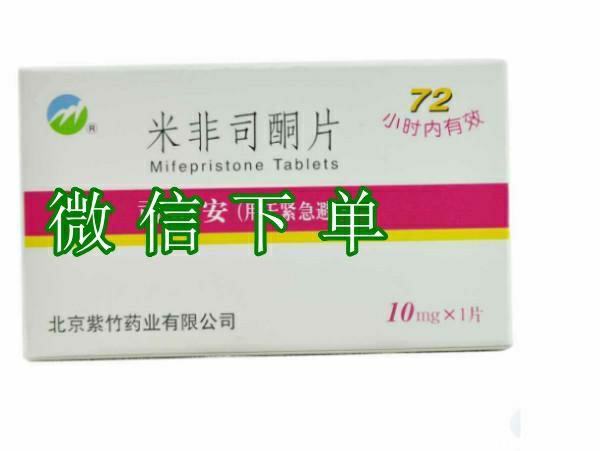
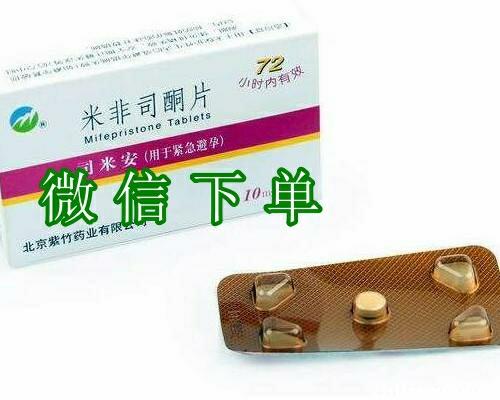
【堕胎药商家联系方式货到付款_第一时间发货安排+包邮全国+正品】支持流产药、打胎药货到付款,只要顺丰能到的地方,我们就支持货到付款,药品为医院专用药,收到后可扫码查询真伪,确认药品无误后支付货款。联系我们,2天送达
意外怀孕不用太担心,只要你是是早期怀孕49天内,完全可以自行够药在家使用,但是前天是自己不是宫外孕情况,紫竹息隐打胎药米非司酮片流产药米索前列醇片是百分之80医院使用的药物流产药,只需三天时间就可以轻松把孕囊排出,算是早期意外怀孕真正的无痛无创伤的口服打胎药了,80几年近入临床试验,9几年上市销售,至今已近快30年历史了,安全性早已近得到了市场的严重,快速流产给你生活工作学习带来了太多时间,对生体恢复也带来极大的帮助,药物堕胎比手术流产清宫刮宫带来的伤害几乎可以不计。所以意外怀孕选对方式处理很重要,在专业指导的帮助下你也无需过多担心!
网友经历分享:
我吃了米菲没啥事,一切都觉得可以接受,然后吃米索后各种难受,吃完没有十分钟肚子就开始痛起来,然后我就躺在病床上,我想着等好了一点再去溜达一下,溜达了一会没啥反应,就想着跳楼梯吧,跳了有一个小时候吧才排出孕囊。这里我还是挺顺利的,我爬楼梯的时候就感觉一直在流血,过了一会儿我去厕所换个卫生巾,然后孕囊的就来了,然后躺着休息。后面签了拒绝清宫就出院了,整个人还比较虚。
hy112。Zhili123。cOm然后大家注意流产后?即使?短效避孕药和慕芙滋。可以?幅度缓解疼痛和出?,?且有助于?宫内膜的恢复。连吃14天短效避孕药后可以进??额外防护措施的性?活。流产后的第?次?经会出?量?较?,疼痛也会?较剧烈,服?避孕药也能够减轻这些问题。其实最好从服??索的第?天就开始吃(因为流产后身体就?即恢复了?育能?,拖太久吃避孕药的话卵?可能到那时已经发育成熟并排出了,这样的话就属于避孕失败,药品说明书也是这么建议的),不过5天之内都是可以的,医?让我周?吃我就乖乖周?吃了。
至于还整个慕芙滋就是帮助恢复的,不仅可以排淤血和残留,防止清宫,还可以增加体内雌激素、改善子宫血流情况,促进子宫腺体及血管增生,让月经正常来。
我药流之后,医嘱说如果身体没有过多不适之后要尽快恢复锻炼,否则?时间卧床会增加?栓?险,体能体质也会下降。我在床上也呆不住,就开始正常运动了,所以还是不能一直躺着的。
网友热议:
支持流产药、打胎药货到付款,只要顺丰能到的地方,我们就支持货到付款,药品为医院专用药,收到后可扫码查询真伪,确认药品无误后支付货款。

堕胎药商家联系方式货到付款_第一时间发货安排+包邮全国+正品
吃复方米非司酮片后没反应怎么办呢?
问题描述:你好,朋友要药流,请问,吃复方米非司酮片后没反应怎么办呢?
问题分析:
你好,复方米非司酮片中米非司酮可通过影响子宫内膜着床期的正常生理变化,干扰孕卵着床的过程,从而降低了着床率,避免了妊娠;双炔失碳酯可使宫颈的粘液分泌量减少,粘稠度增加,不利于精子穿透,能影响子宫内膜的正常发育,不利于孕卵着床,在临床上本品与米索前列醇片配伍,能终止停经49天内的妊娠。患者服用复方米非司酮片终止早孕时,必须与米索前列醇片配伍,否则单独使用无效,所以,吃复方米非司酮片后没反应是正常的,建议患者去咨询医生,在医生的指导下合理用药。
意见建议:
服用复方米非司酮片终止早孕失败者必须进行清宫手术终止妊娠,有长期吸烟史的妇女,使用本品前向医生讲明。女性流产后一个月内不要同房,否则容易感染,过后应采取避孕措施,,以免再次受苦,要注意下体清洁,防止造成妇科感染。
以下资讯可略过:
李宁教授:如何破局我国临床研究面临的机遇和挑战?
·中国临床试验实施质量基本达到国际水准,国内核查标准比FDA更严格;
·监管方对科学性的重视提升,是临床试验行业的重大利好;
·新药研发要打破“交棒模式”,全链条融合提高转化率;
hy112。Zhili123。cOm·建立专职临床试验团队和研究型病房,重视CRC群体、改善其工作条件。
Article List
近期,中国医学科学院肿瘤医院GCP中心李宁教授等在《中华肿瘤杂志》发表《基于科学监管体系的中国药物临床试验实施质量国际评估比较》一文,对国内临床试验质量的实际情况进行全方位分析探讨。
当前中国临床试验行业现状和质量标准、科学监管和转化创新能力,究竟处于怎样的水平、还有哪些差距和不足?对此,在由中国医药创新促进会指导、艾美达医药咨询承办的中国医药创新政策论坛现场,中国医学科学院肿瘤医院副院长、临床研究国家级质量评价和促进中心(肿瘤领域)常务副主任李宁教授接受了主办方采访。
李宁教授指出,经过多年的实践与努力,中国临床试验科学监管体系、实施质量和效率、优化流程机制等方面已有了很大提升,在一定程度上获得了行业乃至国际认可。但我国临床试验能力仍有不少的提高空间,同时利用新模式提高转化成功率、增强行业教育及监管工作,提升临床试验良好环境,有助于我国临床试验行业的发展,更对研究成果转化具有重要推动作用。
01
中国临床试验的监管变迁
Q:前段时间,关于“中国临床试验质量究竟如何”的话题引发了行业讨论。对此您的看法是?
A:国家药监局在2015年开启的“722核查”,不仅推动了临床试验监管体系的改革,也重塑了整个临床研究行业的角色分配,提高了各方团队对于临床试验实施质量的重视程度。2017年我国加入ICH之后,更是在监管体系上整体对标FDA、EMA和PMDA等国际标准要求,全方位提升监管水平。
随后,在一系列密集出台的法规和指导文件的引导下,我国也进一步建立起一套具有中国特色的临床试验实施质量监管体系。CFDI核查不仅关注项目和申办方,也将临床试验机构和研究者作为重点对象,且设有中国特有的机构日常监督检查,充分利用机构负责制和主要研究者(PI)负责制双保险机制的优势,强化对临床试验全流程的监督监管。另外,在核查队伍的组成方面,我国核查专家通常情况下会有4-5人,包括一位核查组长,通常来自CFDI,组员则可能来自于医院GCP办公室或是相关领域人员,同时为了公正公平,省/市级的药监部门通常会委派观察员观摩整个核查过程。
在监管环境得到明显优化的情况下,我国临研行业各方团队也在积极学习制度法规,提高自身规范性,尽可能保证临床试验实施过程的质量及试验数据的真实可靠。
hy112。Zhili123。cOmQ:近期,您牵头发表的《基于科学监管体系的中国药物临床试验实施质量国际评估比较》一文,对国内临床试验质量也进行了全方位分析探讨。请您谈一下我国临床试验实际上处于什么水平?
A:评价临床试验质量不能空口无凭,我们可以通过FDA的核查结果来客观的看待国内的临床试验质量。
FDA现场核查的结论分为“不需要采取行政措施”(NAI)、“发现问题,自愿采取行政措施”(VAI)和“严重问题,需要采取官方行政措施”(OAI)三类。根据我们整理的数据来看,2009年至2023年7月,我国机构共接受FDA核查45次,2016年之后相较前期实施质量逐年提升的趋势明显,结果均为合格,严重问题零发生,NAI由48.0%提高至85.0%,逐渐高于FDA核查美国本土机构的同期结果(71.1%),仅有的两次OAI问题均发生于2016年之前。
同比美国核查本土的数据可以看出,如果说“722”之前中国的临床试验实施质量与国际水平尚有一定差距,但近年来在行业各方的努力之下已经有了明显的提升,逐渐达到和符合国际水平和标准。而且FDA进行核查的医院并不均是像我院这样的国家级医学中心,他们更多核查的是省级,甚至是省级以下的肿瘤医院或者综合医院,这说明我们国内临床试验质量的提升不是偶然的、个别的,而是整体的,平均的。
Q:目前中国的临床试验数据受行业认可程度如何?
A:中国临床试验数据认可度可以从我国参研的上市新药中得到验证。2016年后,越来越多的中国临床试验数据及结果为新药获批上市提供理论支撑,利用中国临床试验数据支持FDA和NMPA批准上市的抗肿瘤新药数量也逐年增多。
以抗肿瘤新药为例,过去10年中我国有100余种抗肿瘤新药成功上市,经过临床应用和市场的检验,至今尚无撤市,中国药企开发的抗肿瘤新药被纳入专业指南的次数也持续增加。中国药企的37种新药(58.7%)被纳入2022版CSCO指南,15种新药(23.8%)被2023版NCCN指南收录。可以看出,中国的临床试验数据质量在临床实践使用中逐渐被业界所接受。
我自己在实际工作中也有比较深刻的体会。在与其他国际医疗机构、企业交流的过程中,我们有了更多的话语权,更多的企业认可我国的临床研究数据,将更多重要的临床试验项目安排在国内进行,这都是我国临床研究水平提高的力证。
Q:您觉得我们自身还有哪些不足,下一步应向哪些方面加强和发展?
目前中国的临床试验还在快速发展阶段,仍有一些问题需要我们持续关注。例如,尝试利用已经获得的临床试验数据质量结果和质量关键要素,建立基于风险的科学化监管策略,探索临床试验风险预警和分级处理,来补充临床试验全链条的风险管控。我们还应持续推进临床研究能力建设,提升申办方和研究者的研发设计能力,以及研究团队参与人员的科学研究水平,从根本上提高我国临床试验的质量。另外,加强与国际监管和行业的宣传交流合作,提高中国临床试验的行业声誉和国际影响力也十分必要。
02
加强科学监管
是行业重大利好
Q:资本寒冬的当下,市场越来越渴望提高临床转化效率,我国当前的转化效率如何,还需要哪些提升?
A:临床试验最终目标是让更加安全有效的新药上市,为有需要的患者提供更多治疗选择。我们对于产品质量的要求不断提升,相应的研发成本同样也会上升。临床转化并不一定以实体产物的形式出现,可能是一种治疗方案,也可能是一个实体的药品或者器械。但临床转化的逻辑是共通的,就是转化过程中必须有自己的理论被证实,同时也能证伪。
怎样提高这种转化的成功率?首先要认清一个事实,就是临床转化本身就是伴随风险的,而且风险很大。比如CNS三大期刊,每年关于肿瘤相关的论文有5000多篇,但相关的临床试验只有300多项进行。全球每年获批的肿瘤相关适应症50多个,新增药物更是不到20个。
当前,药物研发尚处于一种“交棒模式”中,即前期的科研人员做好了理论,随后就把这个研发工作交接给了下一波工作人员,这样依次交接下去,最后再交到临床试验人员手中。这种模式的弊端在于,每个工种只负责自己的工作,与上下游之间其他工作人员不能形成交流,自然也不会对其他的工作负责。
hy112。Zhili123。cOm我们希望能把药物研发工作的链条整合起来,形成类似“多学科诊疗(MDT)”的模式。在药物最初研发设计时,就应该想好最终的目的是什么,也就是要有对应的临床需求,同时结合上下游的工作人员,甚至可以涉及监管层面的人员,共同参与开发策略设计。我相信这种全链条整合式的模式,应该能大大提高我们当前的临床转化率。
Q:临床试验持续创新发展,目前监管的趋势和关注有哪些变化,对临床试验及整个医疗行业来说意味着什么?
hy112。Zhili123。cOmA:近期相关部门动作不断。7月初,国家药品监督管理局发布《药物临床试验机构监督检查办法(试行)(征求意见稿)》,对药物临床试验机构日常监督检查工作规范化、制度化。随后,国家药品监督管理局食品药品审核查验中心(CFDI)发布《药物临床试验机构监督检查要点和判定原则(征求意见稿)》,进一步明确相关监督检查工作的要点、细则。7月底,国家药品监督管理局药品审评中心连发三项指导原则,《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》,围绕“以患者为中心”对临床试验设计、实施及评价全流程进行规范。
目前来看,我们的监管正在逐渐加强科学属性。临床研究本身就是一个专业的学科,相应的监管也要从管理方法、评价标准、监管责任、监管体系等方面适应这种科学属性。当前临床研究行业存在着进步空间。比如,如何判断一个药物的好或者坏,像肿瘤药,是延长PFS(无进展生存期,Progression-free Survival)好,还是延长OS(总生存期,Overall Survival)好?这是一个科学性的问题,需要我们整个行业来探讨、来调整。现在监管已经开始发现这些问题,并制定了相关内容,这对临床研究行业是重大利好。
03
提升临床试验质量与效率
医肿是如何做的?
Q:随着中国临床研究飞速发展和创新能力持续增强,在临床试验开展的不同时期会产生新的机遇和挑战,您作为医疗机构的管理者,遇到了哪些难点问题,对此都尝试了哪些措施?
A:一项临床试验在研究中心开展的过程中,需要经过很多次审查、沟通、协调。所以,程序多是首先被大家诟病的问题,尤其是大医院里科室多、部门细,进了医院大门甚至不知道找谁。所以,我们中国医学科学院肿瘤医院的办法是实行中心化建制,即GCP中心负责所有临床研究工作,提供一站式服务,不需要再跑其他的部门。
对于整个办事流程,我们推出了详细的办事手册,每两年就更新一次,并且列出明确的时间进度表。另外,我们也是国内首家做到接受中心伦理的医院,通过前置立项、前置伦理、合同并行的措施,不断加快临床试验启动前的沟通效率、压缩整体试验的进行周期和成本。
Q:众所周知,医肿作为行业中临床试验承载量非常大的一家研究机构,是如何解决医生常规临床工作和参与临床试验的时间和精力问题的?
A:我们的办法是成立了一支高水平的专职临床试验团队,包括专职研究医师、研究药师、护理以及数统人员,他们是来自国内一流院校、全职投入临床研究的多学科人才。为我院研究者提供全面的临床试验支持和服务,让研究者能将宝贵精力投入到最重要的临床试验决策中,专心做好最关键的受试者的临床治疗判断,重点关注和掌握临床试验中新药的安全性和有效性。
还有硬件设施方面。我们设置了研究型病房,患者可以在这里完成采血、静脉用药、淋巴单采、膀胱灌注等,也不需要跟门诊的患者“抢”床位。目前我们的研究型病房每年收治患者8000多人次,也是全院最繁忙的部门之一。面向受试患者,尽可能的减免程序,可以做到零押金无垫付进行住院,解决患者治疗中的经济困难。
另外,我要特别提一下CRC这个群体,他们是近年来临床试验中非常重要的角色。我们曾经做过一个调查,主要是为了探究试验整体用时以及工时分配,最终结果显示临床试验项目有60%的工作时间需要CRC的支持和协助。为了方便他们工作,我们医院也对CRC进行统一的管理和安排,实行员工化待遇、专业能力培养、配备办公工作条件,今年新增安排了700平米办公场所。
Q:综上,临床试验行业在近几年的改善可谓巨大,那么如今如何让临研行业甚至整个社会逐渐转变对于临床试验的客观认知?
A:临床研究是以患者为中心而展开的研究,这决定了从业者必须跟上患者不断变化的需求,处于长期学习的状态。我们医院针对行业特性开展了许多培训活动,比如面向研究者的培训和面向监管人员的交流。从行业内部提升对临床试验的认知。
其中,我们面向全国研究型医院中突出的青年研究者,提供进阶式的临床研究技能培训。这是一个着眼于5年、10年后的中国创新临床研究,实行小班教学,培训时长至少1年以上。我们希望通过这个活动,将这批青年研究者培养成为未来的Leading PI,为中国的临床研究留下一批人才。
另外,不得不谈的是,受试者招募难一直是临床试验中的困境,公众对于临床试验的印象一直是偏负面的。比如一提到细胞治疗,大家马上就联想到“魏则西事件”。中国的临床试验不仅要得到专业上的认可,同时也需要整个社会大众的认可。我们希望能扭转这种偏见,为此我们在国际临床试验日(5月20日)这天举办公益宣传活动,把临床试验的目的、流程以及能带给受试者的益处讲清楚——参加临床试验,是参与人类医学的发展,能为治疗更多的患者作出贡献。目前,我们已经成立了临床研究方面的患者咨询委员会,围绕着以患者为中心,把患者的真实感受融入临床研究工作中。当我脱下白大褂与患者交流时,身份的变化也让我从更多的角度来理解患者。
「堕胎药商家联系方式货到付款 」、「怀孕多久可以打胎药」、「打胎需要花多少钱」、「打胎药要多少钱一盒」、「打胎药网上联系方式」、「吃什么药容易流产」、「吃什么药打胎」
关于《堕胎药商家联系方式货到付款_第一时间发货安排+包邮全国+正品》就介绍到这里!流产药、打胎药米非司酮片顺丰包邮,诚信商家,值得信赖!快递保密发货,维护客户隐私!正规厂家出厂,品质无忧。

